出水氨氮異常 有哪些迅速、有效的應急手段?
在污水處理廠硝化系統出現問題,出水氨氮超標時,想要迅速、有效的去除氨氮,只能通過物理化學的手段來應急了!常用且有效的物化手段目前只有折點加氯及沸石吸附法!市場上的很多氨氮去除劑就是次氯酸鹽,就是就是利用折點加氯的原理!本文詳細介紹一下兩種工藝,讓大家能做到遇到問題心中有底!
工業凈化www.hihpy.com
一、折點加氯除氨氮 www.hihpy.com
折點加氯法是用化合價+1價氯的化合物次氯酸鈉(或者次氯酸鈣),把水體中的氨氮氧化為氮氣的加工工藝。當然還可以立即把氯氣進入廢水中,運用歧化反應,生成次氯酸,隨后在將廢水中的NH3-N氧化成N2。 空氣凈化www.hihpy.com
當氧化劑添加水里后,水里氨氮會被首要氧化成一氯銨,隨后會被繼續氧化變為二氯胺、三氯銨,三氯銨不穩定,會變為氮氣釋放出來,這就是折點加氯法的反映基本原理和過程,氨的濃度降為零。當氯氣進入量超出該點時,水里的游離氯便會增加。 工業凈化www.hihpy.com
當添加的氧化劑做到足量時,水里的氨氮濃度最低標準(可是并非為零),同時水里余氯成分也是最低標準,超出這一點以后,水里余氯成分就剛開始升高,因而該點稱之為折點,該狀況下的氯化稱之為折點氯化。但在實際生產中,應用折點加氯法往往存在折點、加氯量不好判斷的情況。
水凈化www.hihpy.com
1、加氯量-余氯曲線 科曼環保www.hihpy.com
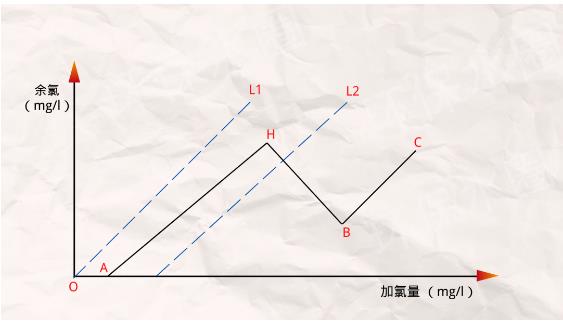
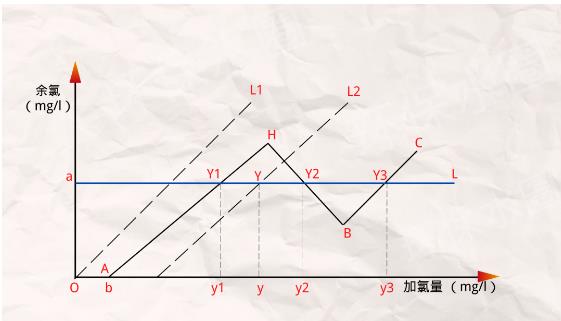
看懂加氯量-余氯曲線,是用好折點加氯法的關鍵所在。在水的加氯處理中,加氯量與余氯的關系如下圖所示。曲線的x軸和y軸分別代表加氯量和余氯量,單位為mg/l。其中,水中的加氯量可分為需氯量和余氯兩部分。如圖所示:
科曼環保www.hihpy.com
 水凈化www.hihpy.com
水凈化www.hihpy.com
- 需氯量是指用于殺死細菌、氧化有機物和還原性物質所消耗的部分。
- 余氯是指為了抑制水中殘余細菌的再度繁殖,尚需維持的少量氯。
- 水中有機物與氯作用的速度有快慢。在測定余氯時,有一部分有機物尚在繼續與氯作用中。
- 水中余氯有一部分會自行分解,如次氯酸由于受水中某些雜質或光線的作用,產生如下的催化分解:2HOCl=2HCl+O2。
1、當水中無細菌、有機物和還原性物質等,需氧量為零,加氯量等于余氯量,如圖中所示的虛線L1,該線與坐標軸成45度角。
2、當水中含有細菌、有機物和還原性物質,但主要不是游離氨時,需氧量OA滿足后就會出現余氯,如圖所示虛線L2,這條線與x軸交角小于45度,其原因為:
3、當水中的有機物主要是氨和氮化合物,情況比較復雜。
當起始的需氧量OA滿足后,加氯量增加,剩余氯也增加(曲線AH段),但后者增長得慢一些。超過H點加氯量后,雖然加氯量增加,余氯量反而下降,如HB段,H點稱為峰點。此后隨著加氯量的增加,剩余氯又上市,如BC段,B點稱為折點。
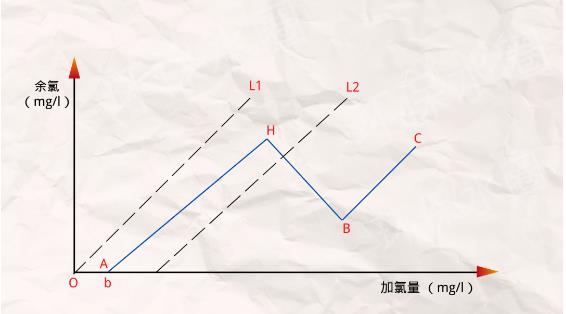
a、在曲線OA段,表示水中雜質把氯消耗光,余氯量為零,需氯量為b,這時雖然也能殺死一些細菌,但消毒效果不可靠。
b、在曲線AH段,加氯后,氯與氨發生反應,有余氯存在,所以有一定消毒效果,但余氯為化合性,其主要成分是一氯氨。氯和氨發生如下反應:NH3+HClO=NH2Cl+H2O。
此時隨著加氯量的增加,化合氯成比例增加,水中氨氮逐漸減少,當加氯量達到H點時,水中的氨降至零,化合性余氯升至最高。
c、在曲線HB段,仍然產生化合性余氯,加氯量繼續增加,會發生如下反應:2NH2Cl+HClO=N2↑+H2O+3HCl。
反應結果使氯胺被氧化成一些不起消毒作用的化合物,余氯量反而逐漸減少,最后到達折點B。
d、在曲線BC段,超過折點B后,已經沒有消耗氯的雜質了,出現自由性余氯,該段消毒效果最好。
由此可見水中含有氨氮時,加氯量-余氯曲線是一條折線,此時對應的加氯法稱為折線加氯法。
2、氨氮含量與加氯量、加氯點的關系
一般情況下, 當 pH值在7左右, 采用折點加氯時,一氯胺、二氯胺、三氯胺同時存在。其中,產生的化合余氯成分以一氯胺為主,二氯胺和三氯胺少量存在(不影響分析),因此,在實踐操作中為簡化分析計算,常常將化合余氯看作一氯胺。
假設水中雜質的耗氧量為b(mg/l),即曲線OA段的耗氧量為b(mg/l),水中余氯控制目標值為a(mg/l)。
如水中含無氨氮,采用游離加氯法。當加氯點為Y時(如圖所示),所需加氯量y=b+1.35a(mg/l)。
如水中含有c(mg/l)氨氮,采用折點加氯法,加氯量需分情況討論:
1、當加氯點被控制在AH段的Y1時,所需加氯量y1=b+1.38a(mg/l)。
需要說明的是,為確保加氯點能被控制在AH段的Y1點,水中氨的含量必須滿足條件:c不小于0.33a(mg/l)。
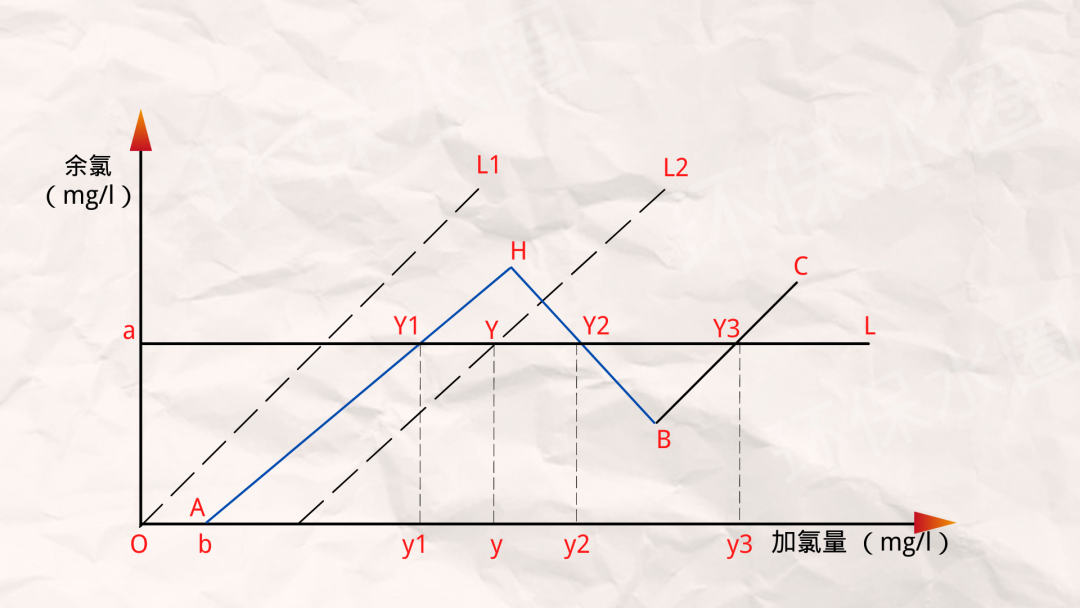
2、當加氯點被控制在HB段的Y2點時,所需加氯量y2=b+4.18c+1.034*(3.03c-a)(mg/l)。
需要說明的是,加氯點被控制在HB段的Y2點,在AH段氨與氯氣反應,水中的氨全部被消耗掉。
3、當加氯點被控制在BC段的Y3點時,所需加氯量y3=b+7.31c+1.35a(mg/l)。
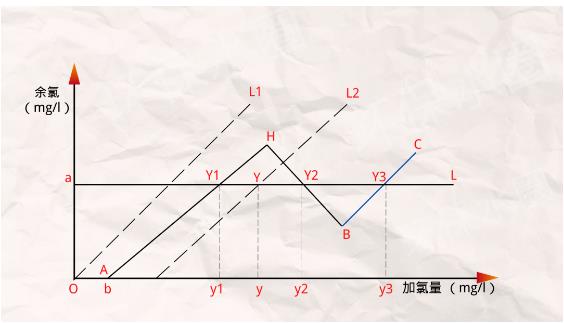
綜上所述,加氯量的大小與水中的雜質含量、氨氮含量、余氯的控制目標值和所選擇的加氯點有關。
當水中雜質含量一定,余氯的控制目標相同時,水中無氨氮時的加氯量要比有氨氮時的加氯量低,也就是說氨氮會引起加氯量的增加,增加量主要取決于加氯點的位置。
如果水中含有氨氮,就采用折點加氯,從余氯-加氯量曲線可知,對應同一個余氯值,可能存在三個不同的加氯點,這三個加氯點分別對應的加氯量有很大差別。
實踐表明,在曲線BC段Y3點采用游離氯消毒的加氯量,要遠遠大于在AH和HB段Y1、Y2點采用化合氯消毒的加氯量。
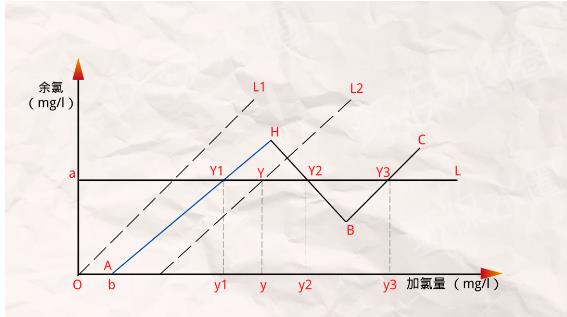
通常Y3點的加氯量可達到Y1點加氯量的2~3倍,為減少加氯量,折點加氯時的加氯點應選擇在加氯量-余氯曲線的AH段,此時的余氯是化合氯。
二、沸石吸附法除氨氮
沸石對氨氮的去除以物理吸附作用與離子交換作用為主,其吸附作用具有“快速吸附,緩慢平衡”的特點。
1、吸附作用
在沸石的組成結構中,[SiO4]和[AlO4]以共角頂的形式聯成硅鋁氧格架,在格架中形成了許多寬闊的孔穴和孔道(占晶體總體積的50%以上),使得天然沸石具有比表面積大(通常在440~1030m2/g);天然沸石往往孔徑均勻,因而可以產生“超孔效應”;在沸石表面所具有的強大色散力作用下,沸石孔穴中分布的陽離子和部分架氧所具有的負電荷相互平衡,使得沸石又具有較強的色散力和靜電力作用;加之沸石所特有的分子結構而形成的較大靜電引力,使沸石具有相當大的引力場,由以上四種因素的綜合作用使得沸石具有很強的吸附性,與其他吸附劑相比,沸石具有吸附量大、高選擇性和高效吸附等特點。
2、離子交換作用
離子交換是指沸石晶體內部陽離子與廢水中 NH4+進行交換的化學過程:在硅(鋁)氧四面體基本單元中,部分氧原子的價鍵未得到中和,使整個四面體基本單元帶有部分的負電荷,為達到電性中和,該四面體基本單元中缺少的正電荷會由附近帶正電的金屬離子陽離子(如 K+、Na+、Ca2+、Mg2+)來補償;廢水中的 NH4+直徑小于沸石的孔穴通道直徑,通過沸石的吸附作用容易進入孔穴到達沸石表面,并與沸石晶格中金屬離子陽離子發生交換并將其置換下來,而且離子交換后的沸石并不發生結構變化,這使沸石具有離子交換特性。廢水中 NH4+與沸石中金屬離子陽離子發生交換反應,使廢水中 NH4+減少,從而實現沸石對氨氮的去除作用。
3、吸附作用影響因素
1)沸石投加量及沸石粒徑對氨氮去除效果的影響
在一定范圍內,沸石用量增加,NH4-N 去除率也增加。但并非用量越多去除效果越好,有研究表明:沸石用量在 2g/L 以上時,去除效果并未明顯增加,另外再增加沸石用量從經濟角度也是不科學的。楊勝科等研究發現:1g 沸石就可以將 200mL 水樣中1mg/L NH4+降至0.2mg/L 以下,此時已低于國家飲用水標準,再增加沸石用量,并未顯著地提高 NH4+的去除率,相反卻使水質產生渾濁,從而影響水體的渾濁度指標,并易使比色測定誤差增大,為此針對不同成分的含氨氮水,應將沸石用量控制在一定的范圍內。
2)溫度對氨氮去除效果的影響
沸石對氨氮的去除效果與廢水的溫度有著密切關系:隨著溫
度升高,沸石對氨氮的吸附能力加強,因為溫度的升高,使得 NH4+離 子動能增加, 運動頻率也隨之增加, 運動頻率較高的 NH4+離子更容易深入到沸石空穴中而被交換吸附。
3)pH對氨氮去除效果的影響
沸石對氨氮的去除隨廢水 pH 值的增加而先增大后減小[7]:當溶液偏酸性時,溶液中存在大量的 H+,H+的半徑要遠小 NH4+的半徑, 比 NH4+更容易與沸石上的金屬陽離子發生交換,不利于 NH4+的交換;當溶液偏堿性時,OH-與 NH4+發生中和反應,生成 NH3,使得水中氨氮以分子形態存在, NH3 不能與沸石進行離子交換,僅吸附現象起作用,氨氮去除能力下降。
參考資料:[1]陳春霧. 折點加氯及其應用[J]. 城鎮供水, 2010(4):3.;[1]王文冬, 楊穎顯. 沸石對水體中氨氮去除機理及影響因素研究[J]. 科學技術創新, 2013, 000(028):124-124.
以上是小編收集整理的出水氨氮異常 有哪些迅速、有效的應急手段?部分內容來自網絡,如有侵權請聯系刪除:153045535@qq.com;
本文地址:http://www.hihpy.com/huanbaojinghua/1101.html